Einzelmolekül-FRET unter Hochdruck
Spektroskopische Untersuchungen unter hohem Druck helfen, biologische Moleküle besser zu verstehen. Um zum Beispiel die Proteinfaltung besser zu verstehen, muss das Protein zuerst entfaltet werden. Dies kann durch Temperatur, Zugabe von Denaturierungsmitteln, pH-Änderungen oder Druck erfolgen. Im Gegensatz zu anderen Entfaltungsmethoden ist die Druckentfaltung sauber, reversibel und beeinflusst die inneren Wechselwirkungen ausschließlich durch die Veränderung der Abstände der Komponenten, wobei die Gesamtenergie nahezu konstant bleibt.
Einzelmolekül-FRET (smFRET) hat sich als leistungsfähige Methode zur Untersuchung des ungefalteten Zustandes von Proteinen bewährt. Der entfaltete oder denaturierte Zustand eines Proteins ist kein einzelner fester Zustand, sondern eine Ansammlung von Zuständen sehr ähnlicher Energien, die sich in einem sehr schnellen Gleichgewicht zueinander befinden. Die denaturierten Zustände sind von besonderem Interesse, da sie der Ausgangspunkt der Proteinfaltungsreaktion sind und die Stabilität als Differenz der freien Energien zwischen dem nativen und dem denaturierten Zustand definiert ist. In Zellen befinden sich der native und der denaturierte Zustand im dynamischen Gleichgewicht. Es gibt auch einige Proteine, die eine Lipid-Doppelschicht nur durchqueren können, nachdem sie in eine teilweise gefaltete oder denaturierte Konformation umgewandelt wurden. Zusätzlich ist der denaturierte Zustand das primäre Ziel für abbaubare Enzyme.
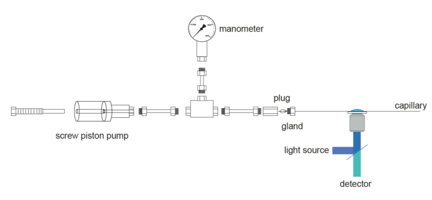
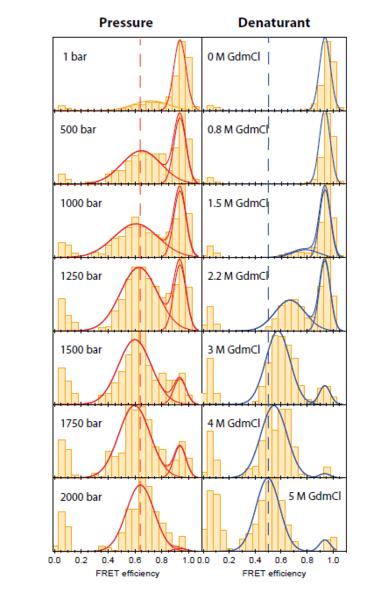
Die Entfaltung durch Temperatur und chemische Denaturierungsmittel wurde durch smFRET aufgeklärt. Die Entfaltung durch hohen Druck ist jedoch bisher nicht nachgewiesen. Wir haben ein Verfahren für smFRET-Messungen unter hohen Drücken (bis 4 kbar) auf Basis einer Silica-Kapillare als Probengefäß entwickelt. Die Abmessungen der Kapillare mit einer Wandstärke, die mit der Dicke von Standard-Mikroskop-Abdeckgläsern vergleichbar ist, ermöglichen den Einsatz an Mikroskopen mit hohen NA-Wasserimmersionsobjektiven.
Kim Colin Reiter

Gebäude 61
,
Raum 218
reiter(at)physik.uni-luebeck.de
+49 451 3101 4211

